间充质干细胞(MSCs)是一种多能干细胞,可从多种组织来源中分离得到,最常见的为骨髓、脂肪组织和脐带。MSCs具有自我更新能力,并可被诱导分化为脂肪、软骨、骨、肝、肌腱和心肌等多种类型的细胞。MSCs可通过抑制T细胞和淋巴细胞增殖等机制调节免疫反应[1, 2]。此外,MSCs还具有抗氧化、抗凋亡、抗纤维化和促血管生成的特性[8]。因此,MSCs在免疫调节和组织再生方面具有显著的临床潜力。事实上,MSCs已在许多临床试验中用于免疫介导疾病和组织损伤的治疗。已使用MSCs治疗的疾病包括肝病、周围神经损伤、移植物抗宿主病、自身免疫性疾病、糖尿病和心脏病[3, 4]。2024年12月18日,美国食品药品监督管理局(FDA)批准Ryoncil(remestemcel-L-rknd)上市,这是一种异体间充质基细胞疗法(mesenchymal stromal cell,MSC),用于治疗对类固醇无反应的急性移植物抗宿主病(SR-aGVHD),适用于年龄为2个月及以上的儿科患者。
临床需求
MSCs在治疗应用中的一个关键限制是其在所有组织中的数量都很少,且分离得到的MSCs数量不足以满足临床需求。通常给予患者的剂量为2 × 106 cells/kg体重[1, 2]。对于某些患者和疾病,为达到所需的治疗效果,需要多次给予多达数亿个MSCs[5, 6]。虽然传统的细胞培养皿和培养瓶在体外扩增MSCs,也可以获得实验级别足够细胞数量,但对于临床用途而言远远不够。如使用细胞培养瓶进行大规模细胞扩增时,需要更多的人力和培养空间。此外,使用细胞培养瓶进行大规模扩增不仅效率低下,而且还会影响细胞质量,因为长期在体外扩增的MSCs可能会失去其干细胞特性[7]。既往研究还报告称,当MSCs达到较高的传代次数时,其增殖和分化潜力会降低[8]。因此,确定一种有效的大规模扩增技术对于在短时间内以具有成本效益的方式获得大量细胞,同时不损害细胞质量而言至关重要。
常见规模化扩增工艺
目前MSCs的大规模扩增主要有4种策略,即多层细胞工厂、转瓶(spinner)、滚瓶(roller bottle)和生物反应器。四种方法各有优劣。

*本文中的2D培养指细胞贴附在培养容器表面培养,3D培养指在多孔微载体上培养,而在实心微载体表面培养则被认为是介于2D和3D之间。
工艺选择的主要考量点
✦ 生产效率和成本:转瓶和滚瓶可以被视作简化版的迷你生物反应器,但和多层细胞工厂一样,都需要大量的人工操作,而且比细胞工厂占用更多的场地。生物反应器则能实现自动化3D培养,占据的车间面积大大减少。
✦ 生产效率和成本:转瓶和滚瓶可以被视作简化版的迷你生物反应器,但和多层细胞工厂一样,都需要大量的人工操作,而且比细胞工厂占用更多的场地。生物反应器则能实现自动化3D培养,占据的车间面积大大减少。
✦ 规模和难度:较小的培养容器仅适合于扩增自体回输用MSCs,而不足以满足每批生产可产生多人份的异体治疗剂量需求。生物反应器因其可控的培养环境,更利于大规模MSCs的扩增,而不会影响细胞活力、表面标记物表达和分化潜力。但操作起来技术门槛较高,需要技术人员具备一定经验。
✦ 表面marker:生物反应器扩增后CD105的阳性表达率降至95%以下(BM-MSCs为88%,AT-MSCs为92%)[9]。其他几项研究也报道了使用生物反应器和转瓶扩增的MSCs上CD90和CD105的表达减少[10,11]。作者推测,这可能是由于剪切力或消化过程引起的细胞损伤。据报道,与CD105+ MSCs相比,CD105- MSCs更容易分化为脂肪细胞和骨细胞,并且更有效地抑制CD4+ T细胞的增殖,但心脏再生潜力却更差。CD90- MSCs与较弱的免疫抑制活性和增强的成骨和脂肪基因分化有关[12,13]。因此,在生物反应器和转瓶扩增后CD90和CD105表达的缺失可能会增强MSCs治疗癌症某些疾病的效力。
✦ 扩增倍数:根据Hassan等人的统计分析,目前所报道的生物反应器和细胞工厂的扩增倍数要比转瓶和滚瓶要高。对于细胞工厂,不同研究的扩增倍数比差异很大,一些研究报告的扩增倍数低于20倍,但有少数研究报告的扩增倍数超过100倍,可能是种子初始密度较低所致[1]。
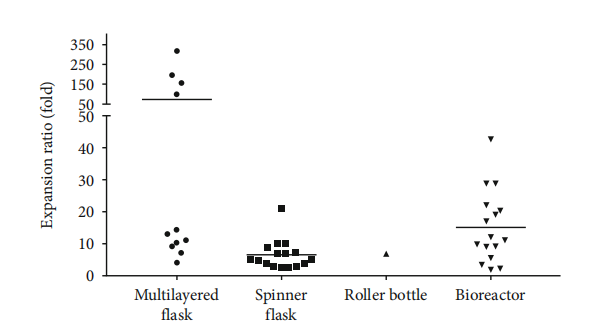
使用不同的生物工艺获得的扩增率[14]
赛科成MSCs大规模培养方案:
赛科成在贴壁细胞培养方面有多年经验积累,在内部测试及客户现场均获得了良好的结果。市面上微载体一般分为可降解与不可降解两种。针对这两种不同工艺,赛科成均有对应的全套解决方案。
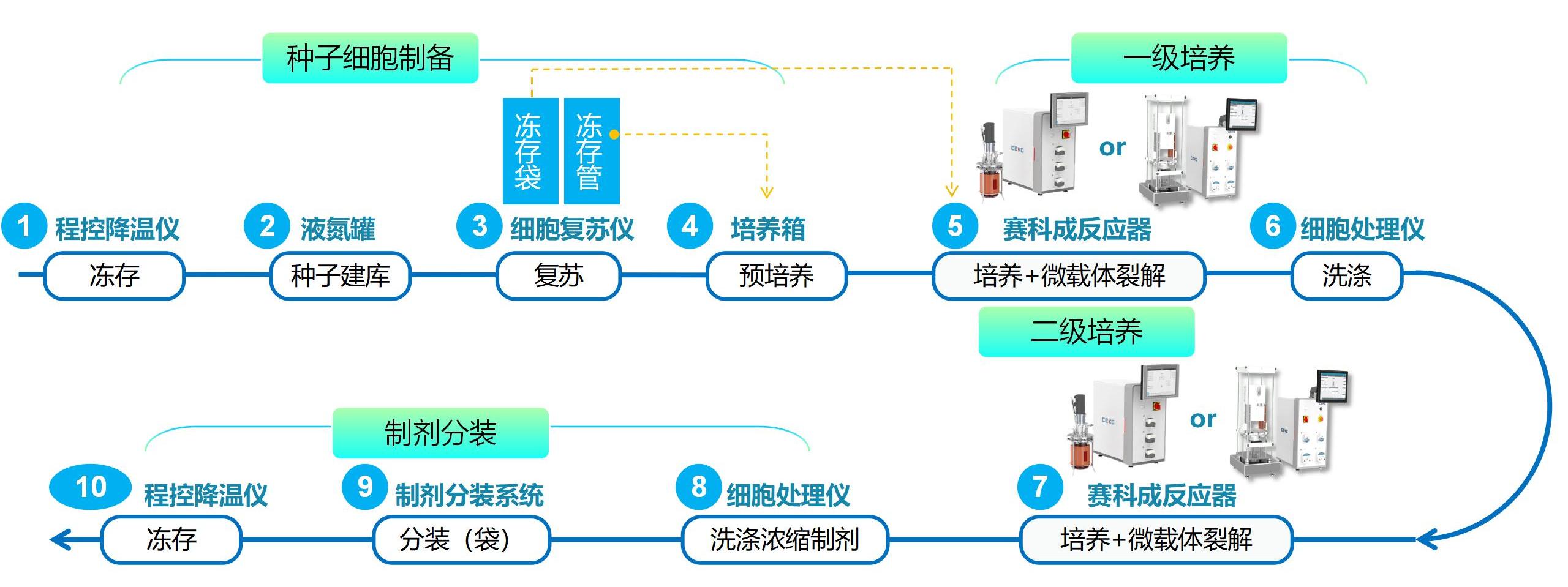
工艺路线1:适用于可降解型球状微载体
细胞可降解型球状微载体表面及孔洞内部进行,是一种更接近于天然组织中3D培养的模式。对MSCs进行扩增,可以配合赛科成玻璃罐体反应器或一次性搅拌式反应器进行扩增,在反应器内完成细胞的贴壁、培养和微载体酶解步骤,并支持逐级放大,最多可以放大至三级,单批次生产百亿量级MSCs。
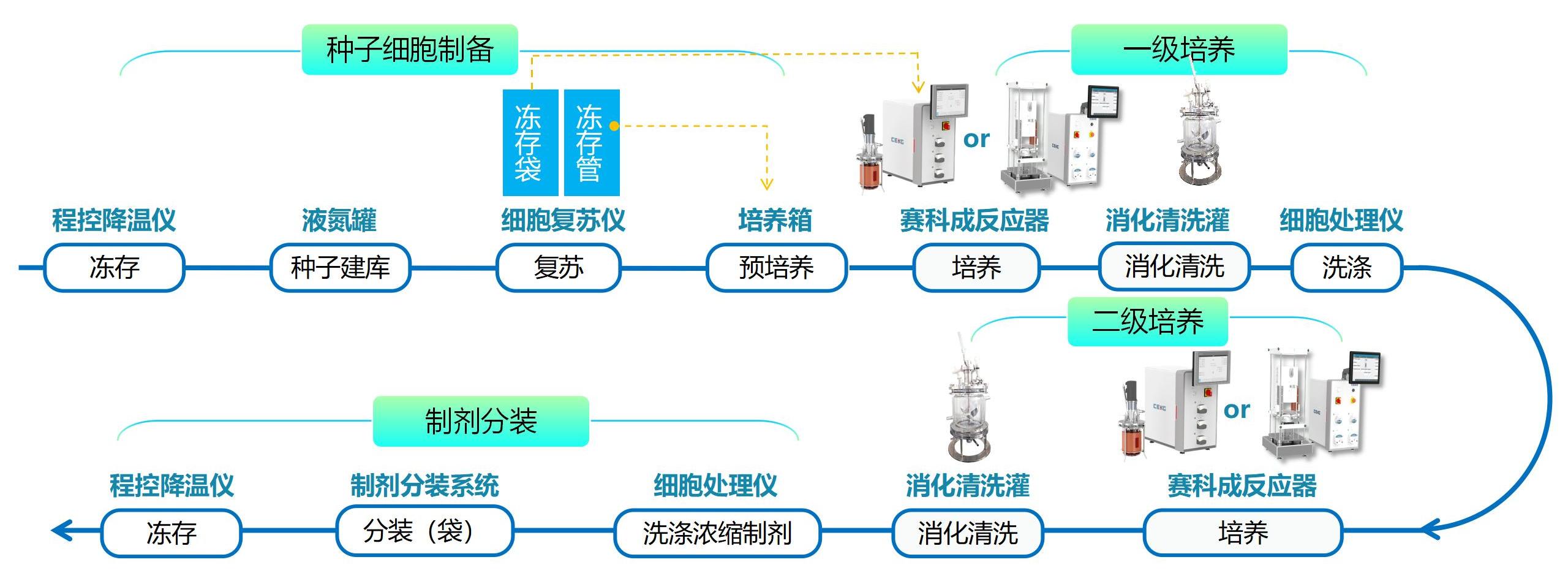
工艺路线2:适用于不可降解型2D微载体
MSCs在不降解型2D微载体表面进行扩增,是一种介于2D和3D之间的培养方式,扩增完成后需要用重组胰酶等消化液进行消化,才能进行细胞的收获或进一步放大培养。可以配合赛科成玻璃罐体反应器或一次性搅拌式反应器进行扩增,在反应器内完成细胞的贴壁和培养,然后转移到专有的微载体消化清洗罐内进行消化和清洗。同样支持逐级放大,最多可以放大至三级,单批次生产百亿量级MSCs。
赛科成生物反应器
赛科成有多种型号规格的生物反应器,并可以提供相应技术方案,支持MSCs培养中培养基、微载体的筛选及工艺优化,小试至大规模扩增工艺全流程。

参考文献:
[1] Usha, Nekanti, and, Lipsa, Mohanty, & and, et al. (2010). Optimization and scale-up of wharton's jelly-derived mesenchymal stem cells for clinical applications. Stem Cell Research.
[2] Caruso, S. R. , Orellana, M. D. , Mizukami, A. , Fernandes, T. R. , Fontes, A. M. , & Suazo, C. A. T. , et al. (2014). Growth and functional harvesting of human mesenchymal stromal cells cultured on a microcarrier‐based system. Biotechnology Progress, 30(4), 889-895.
[3] Watson, N. , Divers, R. , Kedar, R. , Mehindru, A. , Mehindru, A. , & Borlongan, M. C. , et al. (2015). Discarded wharton jelly of the human umbilical cord: a viable source for mesenchymal stromal cells. Cytotherapy, 17( 1), 18-24.
[4] Guan, L. , Guan, H. , Li, H. , Ren, C. , Liu, L. , & Chu, J. , et al. (2015). Therapeutic efficacy of umbilical cord-derived mesenchymal stem cells in patients with type 2 diabetes. Experimental & Therapeutic Medicine.
[5] El-Kheir, W. A. , Gabr, H. , Awad, M. R. , Ghannam, O. , Barakat, Y. , & Farghali, H. A. M. A. , et al. (2014). Autologous bone marrow-derived cell therapy combined with physical therapy induces functional improvement in chronic spinal cord injury patients. Cell Transplantation, 23(6), 729-45.
[6] J. Vaquero, M. Zurita, M. A. Rico et al.(2018), Intrathecal administration of autologous mesenchymal stromal cells for spinal cord injury: safety and efficacy of the 100/3 guideline,Cytotherapy 20(6),806–819
[7] Bonab, M. M. , Alimoghaddam, K. , Talebian, F. , Ghaffari, S. H. , Ghavamzadeh, A. , & Nikbin, B. . (2006). Aging of mesenchymal stem cell in vitro. BMC Cell Biology, 7(1), 1-7.
[8] (2012). Large-scale production of human mesenchymal stem cells for clinical applications. Biotechnology & Applied Biochemistry, 59(2), 106-120.
[9] B. Cunha, T. Aguiar, S. B. Carvalho et al.(2017), Bioprocess integration for human mesenchymal stem cells: from up to ownstream processing scale-up to cell proteome characterization, Journal of Biotechnology 248, 87–98.
[10] Patrícia Aparecida, Tozetti, Rigotto, S. , Caruso, Amanda, & Mizukami, et al. (2017). Expansion strategies for human mesenchymal stromal cells culture under xeno-free conditions. Biotechnology progress.
[11] F. dos Santos, A. Campbell, A. Fernandes-Platzgummer et al. (2014), A xenogeneic-free bioreactor system for the clinical-scale expansion of human mesenchymal stem/stromal cells, Biotechnology and Bioengineering 111(6) 1116– 1127.
[12] Campioni,D.,Rizzo,R.,Stignani,M.,Melchiorri,L.,Ferrari,L.,&Moretti,S.,etal.(2010).Adecreased positivity for cd90 on human mesenchymal stromal cells(mscs)isassociated with a loss of immunosuppressiveactivity by mscs.Cytometry Part BClinical Cytometry,76B(3), 225-230.
[13] Moraes, D.A.,Sibov,T.T.,Pavon,L.F.,Alvim,P.Q.,Bonadio,R.S.,&DaSilva,J.R.,etal.(2016).Areductionincd90(thy-1)expression results in increased differentiation of mesenchymal stromal cells.Stem CellResearch&Therapy, 7(1).
[14] Hassan, M. N. F. B. , Yazid, M. D. , Yunus, M. H. M. , Chowdhury, S. R. , & Law, J. X. . (2020). Large-scale expansion of human mesenchymal stem cells. Stem Cells International, 2020(1), 1-17.
如果您有更多需求,点击按钮,提交信息,我们会第一时间给您回复。
If you have more requirements, click the button to submit information, and we will reply to you as soon as possible.
版权所有 © 2025 All Rights Reserved. 武汉赛科成科技有限公司 鄂ICP备19012202号-1 网站地图 XML 网站建设:烽虎网络